Нещодавно JAMA Oncology (IF 33.012) опублікувала важливий результат дослідження [1], проведеного командою професора Цай Го-ріна з онкологічної лікарні Університету Фудань та професора Ван Цзіна з лікарні Реньцзі Шанхайського університету Цзяотун у співпраці з KUNYUAN BIOLOGY: «Раннє виявлення молекулярних залишкових захворювань та стратифікація ризику колоректального раку I–III стадії за допомогою метилювання циркулюючої пухлинної ДНК та стратифікації ризику)». Це дослідження є першим у світі багатоцентровим дослідженням, у якому застосовується технологія мультигенного метилювання ctDNA крові на основі ПЛР для прогнозування та моніторингу рецидивів колоректального раку, що забезпечує більш економічно ефективний технічний шлях та рішення порівняно з існуючими методами технології виявлення MRD, що, як очікується, значно покращить клінічне використання прогнозування та моніторингу рецидивів колоректального раку, а також значно покращить виживання та якість життя пацієнтів. Дослідження також отримало високу оцінку журналу та його редакторів, і було включено до ключових рекомендаційних статей у цьому випуску, а професора Хуана Руїса-Баньобре з Іспанії та професора Аджая Гоела зі США запросили для його рецензування. Про дослідження також повідомило GenomeWeb, провідне біомедичне видання у Сполучених Штатах.

Колоректальний рак (КРР) – поширена злоякісна пухлина шлунково-кишкового тракту в Китаї. Дані Міжнародного агентства з дослідження раку (МАДР) за 2020 рік показують, що 555 000 нових випадків у Китаї становлять близько 1/3 світового показника, при цьому рівень захворюваності підскочив на друге місце серед поширених видів раку в Китаї; 286 000 смертей становлять близько 1/3 світового показника, що є п'ятою за поширеністю причиною смерті від раку в Китаї. П'ята причина смерті в Китаї. Варто зазначити, що серед діагностованих пацієнтів стадії TNM I, II, III та IV становлять 18,6%, 42,5%, 30,7% та 8,2% відповідно. Понад 80% пацієнтів перебувають на середній та пізній стадіях, а 44% з них мають одночасні або гетерохронні віддалені метастази в печінку та легені, що серйозно впливає на період виживання, загрожує здоров'ю наших мешканців та спричиняє важкий соціальний та економічний тягар. Згідно зі статистикою Національного онкологічного центру, середньорічне зростання вартості лікування колоректального раку в Китаї становить приблизно від 6,9% до 9,2%, а особисті витрати пацієнтів на охорону здоров'я протягом одного року після встановлення діагнозу можуть становити 60% доходу сім'ї. Онкологічні хворі страждають від цієї хвороби, а також відчувають великий економічний тиск [2].
Дев'яносто відсотків уражень колоректального раку можна видалити хірургічним шляхом, і чим раніше виявлено пухлину, тим вищий п'ятирічний рівень виживання після радикальної хірургічної резекції, але загальний рівень рецидивів після радикальної резекції все ще становить близько 30%. П'ятирічні показники виживання при колоректальному раку в китайському населенні становлять 90,1%, 72,6%, 53,8% та 10,4% для I, II, III та IV стадій відповідно.
Мінімальна залишкова хвороба (МЗХ) є основною причиною рецидиву пухлини після радикального лікування. В останні роки технологія виявлення МЗХ для солідних пухлин швидко розвивалася, і кілька вагомих обсерваційних та інтервенційних досліджень підтвердили, що післяопераційний статус МЗХ може вказувати на ризик післяопераційного рецидиву колоректального раку. Тестування цтДНК має переваги неінвазивності, простоти, швидкості, високої доступності зразків та подолання гетерогенності пухлини.
У рекомендаціях NCCN США щодо раку товстої кишки та рекомендаціях CSCO Китаю щодо колоректального раку зазначено, що для визначення ризику післяопераційного рецидиву та вибору ад'ювантної хіміотерапії при раку товстої кишки тестування ctDNA може надати прогностичну та предикативну інформацію для прийняття рішень щодо ад'ювантного лікування пацієнтів з раком товстої кишки II або III стадії. Однак більшість існуючих досліджень зосереджені на мутаціях ctDNA на основі технології високопродуктивного секвенування (NGS), яка має складний процес, тривалий час виконання та високу вартість [3], з незначною відсутністю узагальнюваності та низькою поширеністю серед онкологічних хворих.
У випадку пацієнтів з колоректальним раком III стадії динамічний моніторинг ctDNA на основі NGS коштує до 10 000 доларів США за один візит і вимагає періоду очікування до двох тижнів. Завдяки мультигенному тесту метилювання, що використовується в цьому дослідженні, ColonAiQ®, пацієнти можуть пройти динамічний моніторинг ctDNA за десяту частину вартості та отримати звіт вже за два дні.
Згідно з 560 000 нових випадків колоректального раку в Китаї щороку, клінічні пацієнти, переважно з колоректальним раком II-III стадії (частка становить близько 70%), мають більшу нагальну потребу в динамічному моніторингу, ніж обсяг ринку динамічного моніторингу колоректального раку за допомогою MRD сягає мільйонів людей щороку.
Можна побачити, що результати дослідження мають важливе наукове та практичне значення. Завдяки масштабним проспективним клінічним дослідженням було підтверджено, що технологія мультигенного метилювання ctDNA крові на основі ПЛР може бути використана для прогнозування та моніторингу рецидивів колоректального раку з чутливістю, своєчасністю та економічною ефективністю, що дозволить точній медицині приносити користь більшій кількості онкологічних пацієнтів. Дослідження базується на ColonAiQ®, мультигенному тесті метилювання колоректального раку, розробленому KUNY, клінічна цінність якого для раннього скринінгу та діагностики була підтверджена централізованим клінічним дослідженням.
«Гастроентерологія» (IF33.88), провідний міжнародний журнал у галузі шлунково-кишкових захворювань у 2021 році, повідомив про результати багатоцентрового дослідження лікарні Чжуншань Університету Фудань, онкологічної лікарні Університету Фудань та інших авторитетних медичних установ у співпраці з KUNYAN Biological, які підтвердили відмінну ефективність ColonAiQ® ChangAiQ® у ранньому скринінгу та ранній діагностиці колоректального раку, а також спочатку дослідили його потенційне застосування в прогностичному моніторингу колоректального раку.
Для подальшої перевірки клінічного застосування метилювання ctDNA для стратифікації ризику, прийняття рішень щодо лікування та раннього моніторингу рецидивів при колоректальному раку I-III стадії, дослідницька група включила 299 пацієнтів з колоректальним раком I-III стадії, які перенесли радикальну операцію та збирали зразки крові в кожній точці спостереження (з інтервалом у три місяці) протягом одного тижня до операції, через місяць після операції та під час післяопераційної ад'ювантної терапії для динамічного тестування ctDNA крові.
По-перше, було виявлено, що тестування ctDNA може передбачити ризик рецидиву у пацієнтів з колоректальним раком на ранніх стадіях, як до операції, так і на ранніх післяопераційних періодах. Пацієнти з ctDNA-позитивним результатом до операції мали вищу ймовірність післяопераційного рецидиву, ніж пацієнти з ctDNA-негативним результатом до операції (22,0% > 4,7%). Раннє післяопераційне тестування ctDNA все ще передбачало ризик рецидиву: через місяць після радикальної резекції у пацієнтів з ctDNA-позитивним результатом рецидиву було в 17,5 разів більше, ніж у пацієнтів з негативним результатом; команда також виявила, що комбіноване тестування ctDNA та CEA дещо покращило ефективність виявлення рецидиву (AUC=0,849), але різниця не була суттєвою порівняно з лише тестуванням ctDNA (AUC=0,839). Різниця не була суттєвою порівняно з лише тестуванням ctDNA (AUC=0,839).
Клінічне стадіювання в поєднанні з факторами ризику наразі є основною основою для стратифікації ризику онкологічних пацієнтів, і в сучасній парадигмі велика кількість пацієнтів все ще рецидивує [4], і існує нагальна потреба в кращих інструментах стратифікації, оскільки в клініці співіснують надмірне та недостатнє лікування. На основі цього команда класифікувала пацієнтів з колоректальним раком III стадії на різні підгрупи на основі оцінки клінічного ризику рецидиву (високий ризик (T4/N2) та низький ризик (T1-3N1)) та періоду ад'ювантного лікування (3/6 місяців). Аналіз показав, що пацієнти в підгрупі високого ризику пацієнтів з позитивним результатом ctDNA мали нижчий рівень рецидивів, якщо вони отримували шість місяців ад'ювантної терапії; у підгрупі низького ризику пацієнтів з позитивним результатом ctDNA не було суттєвої різниці між циклом ад'ювантного лікування та результатами лікування пацієнтів; тоді як пацієнти з негативним результатом ctDNA мали значно кращий прогноз, ніж пацієнти з позитивним результатом ctDNA, та довший післяопераційний безрецидивний період (RFS); колоректальний рак I стадії та низького ризику II стадії: у всіх пацієнтів з негативним результатом ctDNA не було рецидивів протягом двох років; отже, очікується, що інтеграція цтДНК з клінічними ознаками додатково оптимізує стратифікацію ризику та краще прогнозує рецидив.
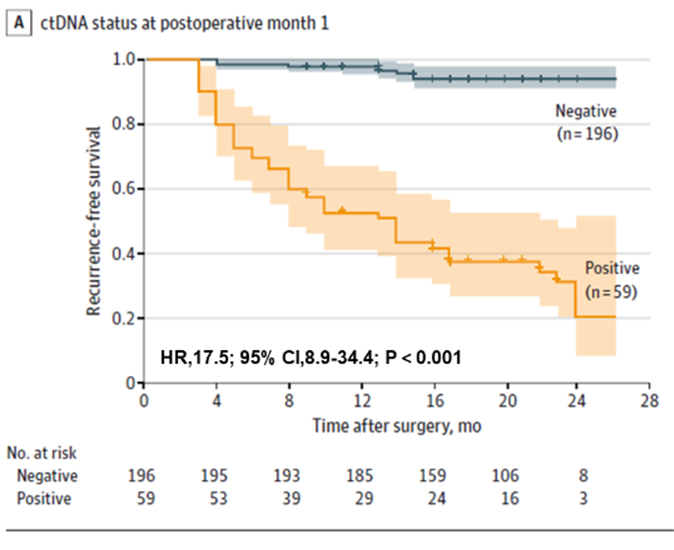
Рисунок 1. Аналіз плазмової ctDNA на POM1 для раннього виявлення рецидиву колоректального раку
Подальші результати динамічного тестування ктДНК показали, що ризик рецидиву був значно вищим у пацієнтів з позитивним динамічним тестуванням ктДНК, ніж у пацієнтів з негативною ктДНК під час фази моніторингу рецидиву захворювання після остаточного лікування (після радикальної операції + ад'ювантної терапії) (Рисунок 3ACD), і що ктДНК може вказувати на рецидив пухлини до 20 місяців раніше, ніж візуалізація (Рисунок 3B), що дає можливість раннього виявлення рецидиву захворювання та своєчасного втручання.
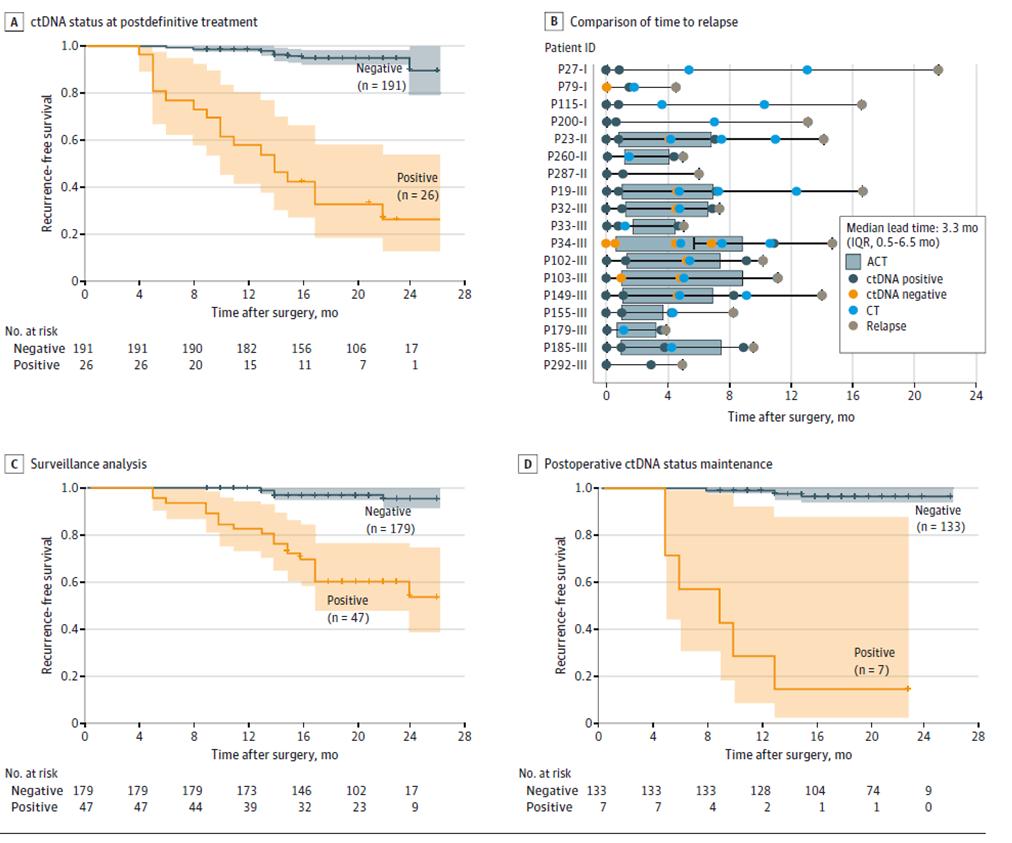
Рисунок 2. Аналіз цтДНК на основі поздовжньої когортної групи для виявлення рецидиву колоректального раку
«Велика кількість досліджень трансляційної медицини в галузі колоректального раку є провідними в цій дисципліні, особливо тестування MRD на основі ctDNA демонструє великий потенціал для покращення післяопераційного ведення пацієнтів з колоректальним раком, дозволяючи стратифікацію ризику рецидиву, спрямовуючи рішення щодо лікування та ранній моніторинг рецидивів».
Перевага вибору метилювання ДНК як нового маркера MRD над виявленням мутацій полягає в тому, що воно не вимагає скринінгу пухлинних тканин за допомогою повного секвенування геному, використовується безпосередньо для аналізу крові та дозволяє уникнути хибнопозитивних результатів через виявлення соматичних мутацій, що походять із нормальних тканин, доброякісних захворювань та клонального гемопоезу.
Це та інші пов'язані дослідження підтверджують, що тестування MRD на основі ctDNA є найважливішим незалежним фактором ризику рецидиву колоректального раку I-III стадії та може бути використане для прийняття рішень щодо лікування, включаючи «ескалацію» та «зниження» ад'ювантної терапії. MRD є найважливішим незалежним фактором ризику рецидиву після операції з приводу колоректального раку I-III стадії.
Галузь МРД швидко розвивається завдяки низці інноваційних, високочутливих та специфічних аналізів, заснованих на епігенетиці (метилювання ДНК та фрагментоміка) та геноміці (надглибоке цільове секвенування або секвенування всього геному). Ми очікуємо, що ColonAiQ® продовжить організовувати масштабні клінічні дослідження та зможе стати новим індикатором тестування МРД, який поєднує доступність, високу продуктивність та цінову доступність і може широко використовуватися в рутинній клінічній практиці.
Посилання
[1] Mo S, Ye L, Wang D, Han L, Zhou S, Wang H, Dai W, Wang Y, Luo W, Wang R, Xu Y, Cai S, Liu R, Wang Z, Cai G. Раннє виявлення молекулярної залишкової хвороби та стратифікація ризику колоректального раку I–III стадії за допомогою метилювання ДНК циркулюючої пухлини. JAMA Oncol. 20 квітня 2023 р.
[2] «Тягар колоректального раку серед населення Китаю: чи змінився він за останні роки?», Китайський журнал епідеміології, том 41, № 10, жовтень 2020 р.
[3] Таразона Н., Гімено-Валієнте Ф., Гамбарделла В. та ін. Цільове секвенування циркулюючої пухлинної ДНК наступного покоління для відстеження мінімальної залишкової хвороби при локалізованому раку товстої кишки. Ann Oncol. 1 листопада 2019 р.;30(11):1804-1812.
[4] Тайєб Дж., Андре Т., Оклін Е. Удосконалення ад'ювантної терапії неметастатичного раку товстої кишки, нові стандарти та перспективи. Cancer Treat Rev. 2019;75:1-11.
Час публікації: 28 квітня 2023 р.
 中文网站
中文网站