Nat Med | Мульти-омічний підхід до картування інтегрованого пухлинного, імунного та мікробного ландшафту колоректального раку розкриває взаємодію мікробіома з імунною системою
Хоча біомаркери первинного раку товстої кишки були широко вивчені в останні роки, чинні клінічні рекомендації спираються лише на стадіювання пухлини-лімфатичних вузлів-метастазів та виявлення дефектів репарації невідповідностей ДНК (MMR) або мікросателітної нестабільності (MSI) (на додаток до стандартного патологічного тестування) для визначення рекомендацій щодо лікування. Дослідники відзначили відсутність зв'язку між імунними відповідями на основі експресії генів, мікробними профілями та стромою пухлини в когорті колоректального раку Атласу геному раку (TCGA) та виживанням пацієнтів.
З розвитком досліджень повідомлялося, що кількісні характеристики первинного колоректального раку, включаючи клітинну, імунну, стромальну або мікробну природу раку, суттєво корелюють з клінічними результатами, але розуміння того, як їхня взаємодія впливає на результати лікування пацієнтів, досі обмежене.
Щоб проаналізувати зв'язок між фенотиповою складністю та результатом, команда дослідників з Інституту медичних досліджень Сідра в Катарі нещодавно розробила та перевірила інтегровану шкалу (mICRoScore), яка визначає групу пацієнтів з хорошими показниками виживання шляхом поєднання характеристик мікробіому та констант імунного відторгнення (ICR). Команда провела комплексний геномний аналіз свіжозаморожених зразків від 348 пацієнтів з первинним колоректальним раком, включаючи секвенування РНК пухлин та зіставної здорової колоректальної тканини, секвенування всього екзому, глибоке секвенування генів Т-клітинних рецепторів та 16S бактеріальної рРНК, доповнене секвенуванням всього геному пухлини для подальшої характеристики мікробіому. Дослідження було опубліковано в Nature Medicine під назвою «Інтегрований атлас пухлин, імунітету та мікробіому раку товстої кишки».

Стаття опублікована в Nature Medicine
Огляд AC-ICAM
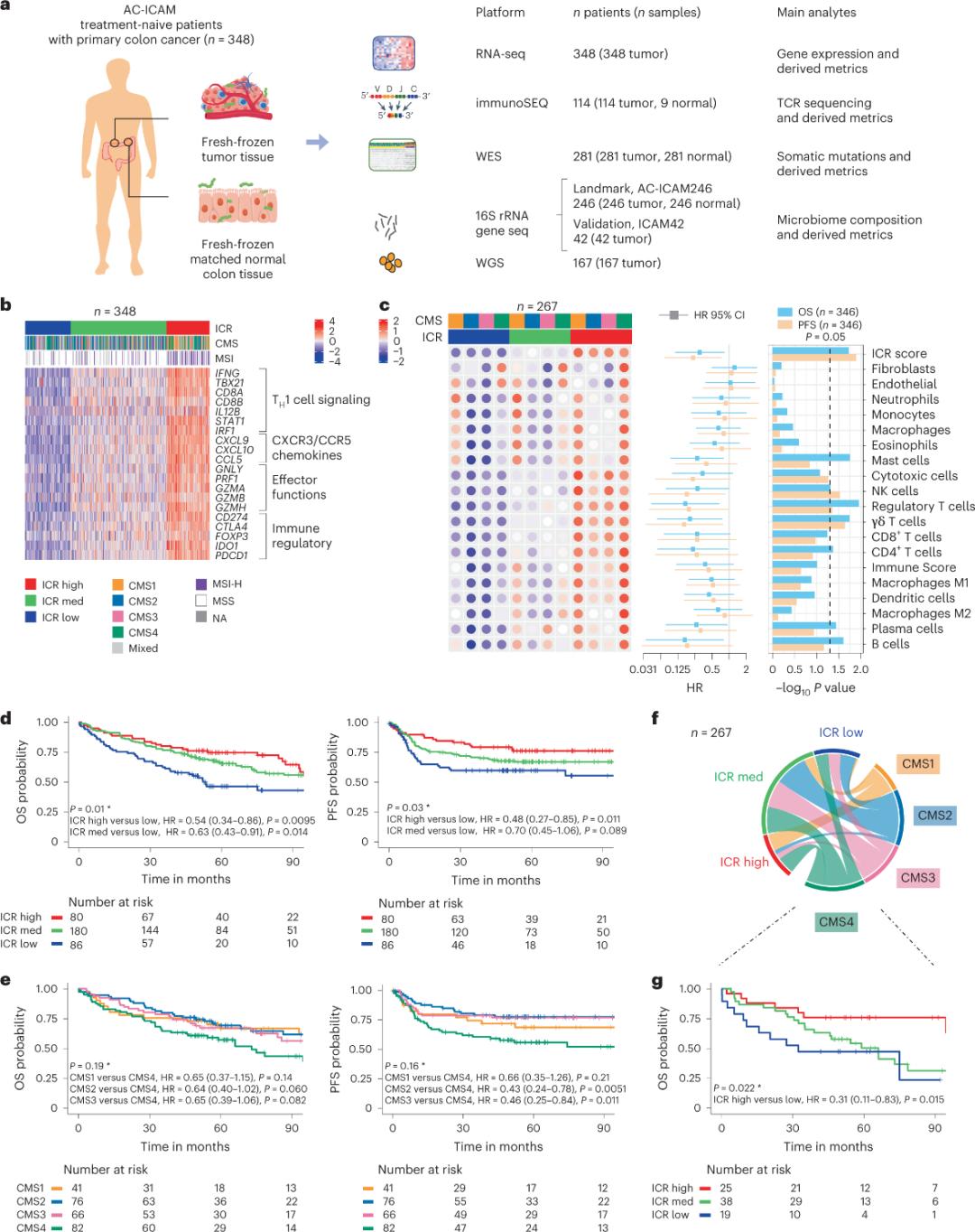
Дослідники використовували ортогональну геномну платформу для аналізу свіжозаморожених зразків пухлини та зіставленої прилеглої здорової тканини товстої кишки (пари пухлина-норма) від пацієнтів з гістологічним діагнозом раку товстої кишки без системної терапії. На основі секвенування всього екзому (WES), контролю якості даних РНК-секвенування та скринінгу критеріїв включення, геномні дані 348 пацієнтів були збережені та використані для подальшого аналізу з медіаною спостереження 4,6 року. Дослідницька група назвала цей ресурс Sidra-LUMC AC-ICAM: Карта та посібник з взаємодій імунітету, раку та мікробіому (Рисунок 1).
Молекулярна класифікація за допомогою ICR
Зафіксувавши модульний набір імунних генетичних маркерів для безперервного імунного спостереження за раком, який називається імунною константою відторгнення (ICR), дослідницька група оптимізувала ICR, об'єднавши його в панель з 20 генів, що охоплює різні типи раку, включаючи меланому, рак сечового міхура та рак молочної залози. ICR також пов'язують з імунотерапевтичною відповіддю при різних типах раку, включаючи рак молочної залози.
Спочатку дослідники підтвердили сигнатуру ICR когорти AC-ICAM, використовуючи підхід спільної класифікації на основі генів ICR для класифікації когорти на три кластери/імунні підтипи: високий ICR (гарячі пухлини), середній ICR та низький ICR (холодні пухлини) (Рисунок 1b). Дослідники охарактеризували імунну схильність, пов'язану з консенсусними молекулярними підтипами (CMS), класифікацією раку товстої кишки на основі транскриптомів. Категорії CMS включали CMS1/імунні, CMS2/канонічні, CMS3/метаболічні та CMS4/мезенхімальні. Аналіз показав, що показники ICR негативно корелювали з певними шляхами ракових клітин у всіх підтипах CMS, а позитивна кореляція з імуносупресивними та стромальними шляхами спостерігалася лише в пухлинах CMS4.
У всіх КМС кількість субпопуляцій природних кілерних (NK) та Т-клітин була найвищою у підтипах ICR з високим імунітетом, з більшою варіабельністю в інших підгрупах лейкоцитів (Рисунок 1c). Імунні підтипи ICR мали різну виживаність (OS) та виживаність без прогресування (PFS), з прогресуючим збільшенням ICR від низького до високого (Рисунок 1d), що підтверджує прогностичну роль ICR при колоректальному раку.
Рисунок 1. Дизайн дослідження AC-ICAM, імуноасоційована генна сигнатура, імунні та молекулярні підтипи та виживання.
ICR фіксує збагачені пухлиною, клонально ампліфіковані Т-клітини
Повідомлялося, що лише меншість Т-клітин, що інфільтрують пухлинну тканину, є специфічними для пухлинних антигенів (менше 10%). Тому більшість внутрішньопухлинних Т-клітин називаються Т-клітинами-свідками (Т-клітини-свідки). Найсильніша кореляція з кількістю звичайних Т-клітин з продуктивними Т-клітинами спостерігалася в субпопуляціях стромальних клітин та лейкоцитів (виявлених за допомогою РНК-секвенування), що можна використовувати для оцінки субпопуляцій Т-клітин (Рисунок 2a). У кластерах ICR (загальна та класифікація CMS) найвища клональність імунних SEQ TCR спостерігалася в групах ICR-high та CMS підтипу CMS1/імунних (Рисунок 2c), з найвищою часткою пухлин ICR-high. Використовуючи весь транскриптом (18 270 генів), шість генів ICR (IFNG, STAT1, IRF1, CCL5, GZMA та CXCL10) були серед десяти генів, позитивно пов'язаних з клональністю імунних SEQ TCR (Рисунок 2d). Клональність TCR за даними ImmunoSEQ корелювала сильніше з більшістю генів ICR, ніж кореляції, що спостерігалися з використанням пухлинно-чутливих маркерів CD8+ (Рисунок 2f та 2g). На завершення, вищезазначений аналіз свідчить про те, що сигнатура ICR фіксує наявність збагачених пухлиною, клонально ампліфікованих Т-клітин і може пояснити її прогностичні наслідки.
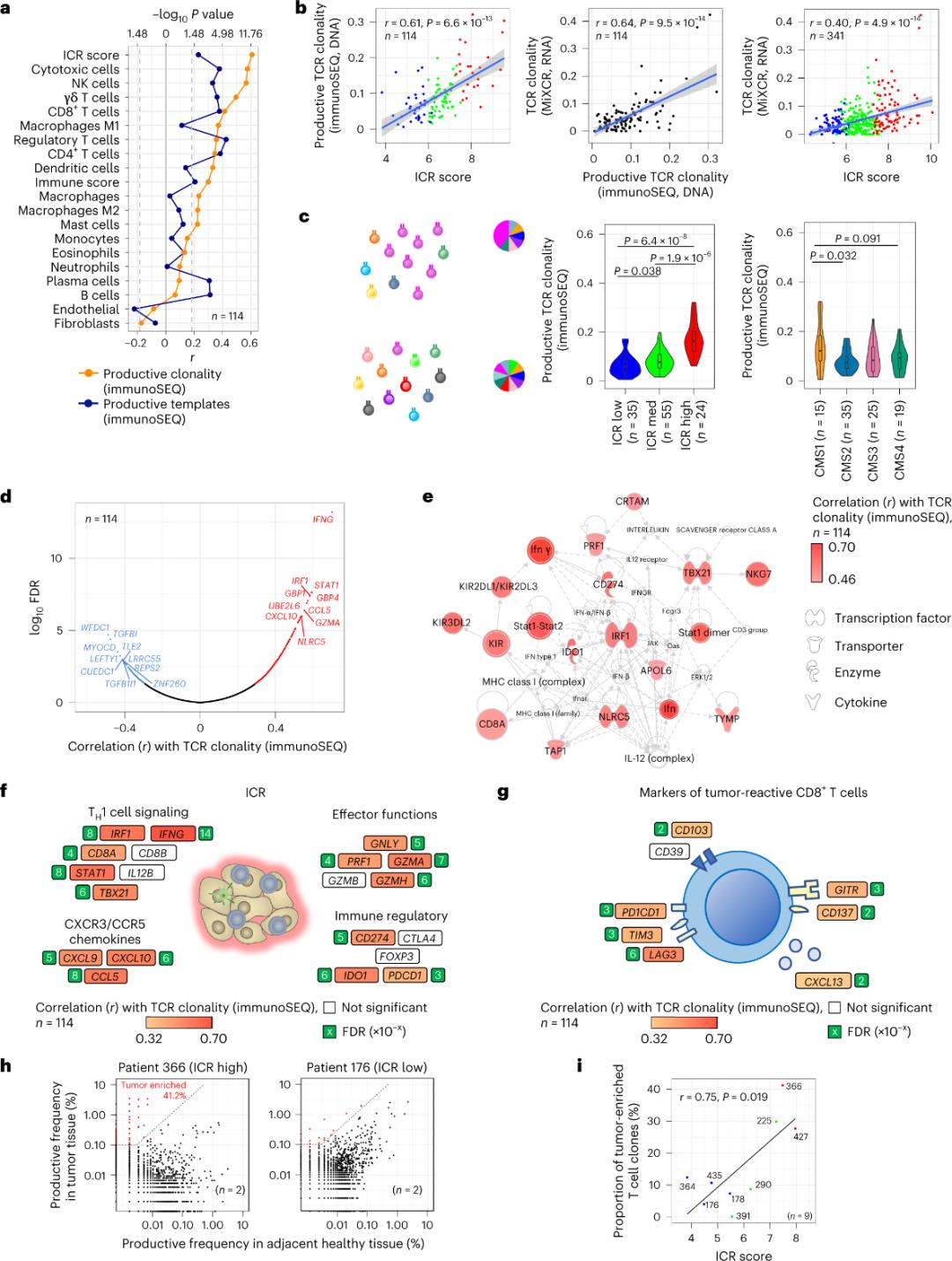
Рисунок 2. Метрики TCR та кореляція з імуноасоційованими генами, імунними та молекулярними підтипами.
Склад мікробіому у здорових тканинах та тканинах товстої кишки, що піддаються раку
Дослідники виконали секвенування 16S рРНК, використовуючи ДНК, екстраговану з підібраної пухлини та здорової тканини товстої кишки від 246 пацієнтів (Рисунок 3a). Для валідації дослідники додатково проаналізували дані секвенування гена 16S рРНК з додаткових 42 зразків пухлин, які не мали підібраної нормальної ДНК, доступної для аналізу. Спочатку дослідники порівняли відносну чисельність флори між підібраними пухлинами та здоровою тканиною товстої кишки. Кількість Clostridium perfringens була значно підвищена в пухлинах порівняно зі здоровими зразками (Рисунки 3a-3d). Не було виявлено суттєвої різниці в альфа-різноманітності (різноманітність та чисельність видів в одному зразку) між пухлинними та здоровими зразками, а в пухлинах з високим ICR спостерігалося незначне зниження мікробного різноманіття порівняно з пухлинами з низьким ICR.
Щоб виявити клінічно значущі зв'язки між мікробними профілями та клінічними результатами, дослідники мали на меті використати дані секвенування генів 16S рРНК для визначення особливостей мікробіому, які прогнозують виживання. У дослідженні AC-ICAM246 дослідники використали регресійну модель OS Cox, яка відібрала 41 ознаку з ненульовими коефіцієнтами (пов'язаними з диференціальним ризиком смертності), які називаються класифікаторами MBR (Рисунок 3f).
У цій навчальній когорті (ICAM246) низький бал MBR (MBR<0, низький MBR) був пов'язаний зі значно нижчим ризиком смерті (85%). Дослідники підтвердили зв'язок між низьким MBR (ризиком) та тривалою загальною виживаністю (OS) у двох незалежно валідованих когортах (ICAM42 та TCGA-COAD). (Рисунок 3) Дослідження показало сильну кореляцію між ендогастральними коками та балами MBR, які були подібними в пухлинній та здоровій тканинах товстої кишки.
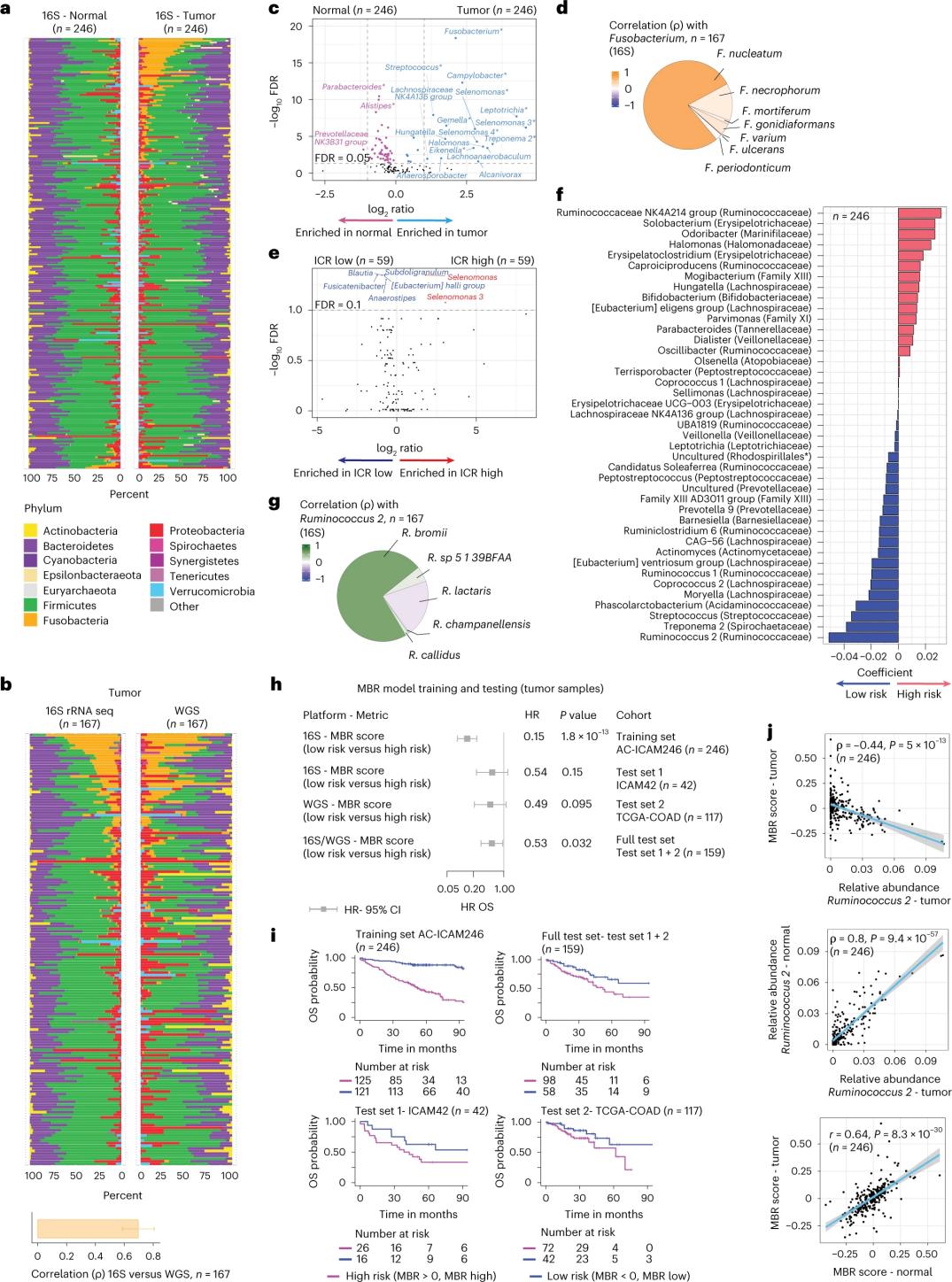
Рисунок 3. Мікробіом у пухлинних та здорових тканинах і зв'язок з ICR та виживанням пацієнтів.
Висновок
Мульті-омічний підхід, використаний у цьому дослідженні, дозволяє ретельно виявити та проаналізувати молекулярну сигнатуру імунної відповіді при колоректальному раку та виявляє взаємодію між мікробіомом та імунною системою. Глибоке секвенування Т-клітин пухлини та здорових тканин показало, що прогностичний ефект ІЦР може бути зумовлений його здатністю захоплювати збагачені пухлиною та, можливо, пухлинні антиген-специфічні клони Т-клітин.
Аналізуючи склад мікробіому пухлини за допомогою секвенування гена 16S рРНК у зразках AC-ICAM, команда визначила сигнатуру мікробіому (оцінку ризику MBR) з сильною прогностичною цінністю. Хоча ця сигнатура була отримана зі зразків пухлини, існувала сильна кореляція між здоровим колоректалом та оцінкою ризику MBR пухлини, що свідчить про те, що ця сигнатура може відображати склад мікробіому кишечника пацієнтів. Поєднуючи оцінки ICR та MBR, стало можливим ідентифікувати та валідувати мультиомічний біомаркер студента, який прогнозує виживання у пацієнтів з раком товстої кишки. Мультиомічний набір даних дослідження надає ресурс для кращого розуміння біології раку товстої кишки та допомагає у розробці персоналізованих терапевтичних підходів.
Час публікації: 15 червня 2023 р.
 中文网站
中文网站